Изучение нейробиологических основ психических расстройств, в особенности биологии депрессии, стало характерной особенностью последнего десятилетия. Во многом это произошло благодаря интеграции основных научных открытий в генетике и нейрохимии нарушений функций мозга, а также выработке новых клинических протоколов с использованием нейровизуализации. Депрессия — одно из самых распространенных психических расстройств. Она имеет сложную комплексную этиологию и различные клинические манифестации. То что вроде бы безобидно называется «Mood disorders, растройства настроения», такие как большое депрессивное расстройство, на самом деле — весьма частые, очень тяжелые и зачастую, угрожающие жизни заболевания.
Пятнадцать процентов случаев большого депрессивного расстройства заканчивается суицидом, а у пациентов, которым посчастливилось обследоваться не в морге, а в больнице, часто обнаруживаются патологии множества систем организма, за которые приходится расплачиваться недееспособностью и преждевременной смертью. Всемирная организация здравоохранения позиционирует большое депрессивное расстройство как одну из самых частых причин утраты трудоспособности во всем мире и в ближайшие годы эта проблема станет еще более серьезной. Множественные факторы риска и разнородная этиология депрессии затрудняет исследования. Ученые пытаются объяснить, каким образом комбинация генетики и факторов среды влияет на начало заболевания, его развитие и тяжесть симптомов. Последние исследования с нейровизуализацией (КТ, МРТ, ПЭТ) показывают взаимосвязь конкретных структурных и функциональных нарушений, на основании чего мы можем предположить, что дисфункция в нервных цепях может быть причиной расстройств настроения.
Понимание взаимосвязи структур мозга, нейротрансмиттерных путей и молекулярных механизмов, задействованных в этих нарушениях, создает нам основу для лучшего понимания клинического фенотипа заболевания. Большое депрессивное расстройство долгое время рассматривалось с точки зрения нейрохимии, но последние исследования установили повторяющиеся случаи уменьшения как объема мозга в определенных частях, так и уменьшения количества и объема глиальных клеток и нейронов в специфических отделах мозга. Текущие исследования показали, что большое депрессивное расстройство возникает из взаимодействия множества предопределенных генетических факторов, а также влияния среды, в которой находится индивидуум. Клинические симптомы не ограничены только эпизодами плохого настроения. Наблюдается полный спектр когнитивных, сенсорных, моторных, анатомических, эндокринных аномалий, расстройств сна, причем все это происходит одновременно.
Магнито-резонансная томография фиксирует у депрессивных пациентов уменьшение серого вещества преимущественно в орбитальной и медиальной префронтальной коре, вентральном стриатуме и гиппокампе по сравнению со здоровыми субъектами при контрольных исследованиями. Дополнительные посмертные невропатологические исследования показали существенное снижение количества кортикальных клеток, глиальных клеток в таких отделах как субгенуальная передняя поясная кора (Cg 25), орбитальная кора, дорсальная антеролатеральная префронтальная кора, а также изменения в передней инсуле и мигдалине. Снижение в глиальных клетках этих областей согласуется с данными последних экспериментов, подтвердивших важную роль глии в регулировании концентрации синаптического глутамата и выработке трофических факторов, важных для строительства и развития межнейронных взаимосвязей. Позитронно-эмиссионная томография зафиксировала очаговые или генерализованные патологии мозгового кровообращения и метаболизма глюкозы в лимбических и префронтальных структурах при расстройствах настроения.
Есть основания полагать, что у пациентов с семейным большим депрессивным расстройством, не получавших медикаментозной терапии, церебральное кровообрашение и метаболизм повышаются в миндалине, орбитальной коре и медиальном таламусе и снижаются в дорсомедиальной/верхней антеролатеральной префронтальной коре и поясной извилине по сравнению со здоровой контрольной группой. Томография позволила выявить наличие функциональных сетей, включая лимбико-таламо-кортикальную или более сложный лимбико-стриопаллидарно-таламо-кортикальный контур, с амигдалой, орбитальной, префронтальной корой и областями стриатума и таламуса. Все эти структуры задействованы в патофизиологии большого депрессивного расстройства. Те же нейронные цепи задействованы у пациентов с первичными неврологическими расстройствами и наиболее хорошо изучены в контексте эпилепсии. Серьезный стресс может послужить причиной начала большого депрессивного расстройства. Активация гипоталамо-гипофизарно-надпочечниковой оси может влиять на многие из вышеперечисленных патологических проявлений. Индуцированная стрессом атрофия нейронов может быть предотвращена удалением надпочечников и усилена высокими концентрациями глюкокортикоидов.
Большое количество пациентов с синдромом Кушинга, где аденома гипофиза является результатом гиперсекреции кортизола, могут проявлять депрессивную симптоматику и снижение объема гиппокампа. Вследствие успешного хирургического лечения объем гиппокампа увеличивается в той же пропорции, в какой уменьшается спровоцированный лечением объем свободной концентрации гидрокортизола в моче. Стресс и глюкокортикоиды также снижают эластичность клеток. Кажется правдоподобным снижения порога клеточной гибели при хроническом или повторяющемся стресса. Точный механизм неясен, предположительно в нем задействована глутаматергическая сигнализация. Снижение эластичности нейронов гиппокампа может вызвать снижение экспрессии нейротрофического фактора BDNF (brain-derived neurotrophic factor) и других факторов, необходимых для выживания и функционирования нейронов. Устойчивое сокращение экспрессии данных факторов может плохо влиять на жизнеспособность нейронов.
Похоже, что эндогенные нейротрофические факторы действуют как ингибиторы каскада реакций, ведущих к апоптозу, а также играют роль в обеспечении клеток необходимыми питательными веществами. Предполагается также, что каскад c циклическим AMP-связывающимся протеином (CREB) регулируется лечением антидепрессантами. Так, длительное лечение может повысить фосфориляцию CREB и увеличить экспрессию главного гена, регулирующегося CREB и кодирующего BDNF. Роль каскада «циклический аденилат-монофосфат (cAMP)-CREB» и BDNF в терапии антидепрессантами изучалась в экспериментах, которые показали, что регуляция данных сигнальных путей положительно сказывается на поведенческих моделях. Несколько исследований говорят в поддержку гипотезы нейротрофического эффекта антидепрессатнов. Лечение антидепрессантами может улучшить регенерацию катехоламиновых аксонных терминалей, усилить рост нейронов гиппокампа и синаптическую пластичность.
Анатомия фронтолимбической сети
Большинство исследований дают основания полагать, что снижение размеров гиппокампа может ассоциироваться с депрессией, а функциональная томография указывает на расстройство фронтолимбической сети у пациентов с большим депрессивным расстройством. Эти результаты коррелируют с экспериментами над животными, исследованиями опухолей у человека и посмертными изучениями. Можно предположить наличие прямого пути от гиппокампа к специфическим структурам медиальной префронтальной коры. Данный путь используется как модель для изучения взаимосвязей между фронтолимбическим структурами, которые, возможно, отвечают за смену настроения 6.
Гиппокамп
Гиппокамп (от греческого "морской конек"), по форме действительно немного напоминает морского конька. Также его назsвают «рогом Аммона» (cornu Ammonis) по имени древнегреческого божества Амона, в нубийской традиции изображавшегося с изогнутыми бараньими рогами. Гиппокамп обладает большим количеством нейронных связей, которые играют центральную роль в исследованиях настроения, обучения, памяти. Гиппокамп также выполняет важные функции в реакции на стрессовые факторы (нейропластичность).
Афферентные пути гиппокампа
Главные гиппокампальные восходящие (афферентные) пути расположены в лобных долях (поля по Бродману 12, 13, и 25), затылочных долях (поля 20, 22, 35, 36 и 38). Они обеспечивают входящие стимулы от сенсорных систем за счет прямых проекций в энторинальную кору. Далее проекции идут в Аммонов рог, в слои CA1, Ca2 и Ca3.
Нейроны из фронтальной коры (поля 9 и 46) и теменной коры (поля 7 и 23) проецируются прямо в гиппокамп (информация поступает в гиппокамп и его основание, subiculum, через зубчатую извилину. Далее, висцеральные волокна от базального и латерального ядер миндалины проецируются в гиппокамп через поле 28. Волокна из переднего и среднего таламических ядер проходят через поясной тракт (cingulum) в энторинальную кору, но один пучок идет сразу в гиппокамп. Проекции из супрамаммилярной области гипоталамуса проходят через свод мозга (fornix) в энторинальную кору и гиппокамп8, рис. 1.
.
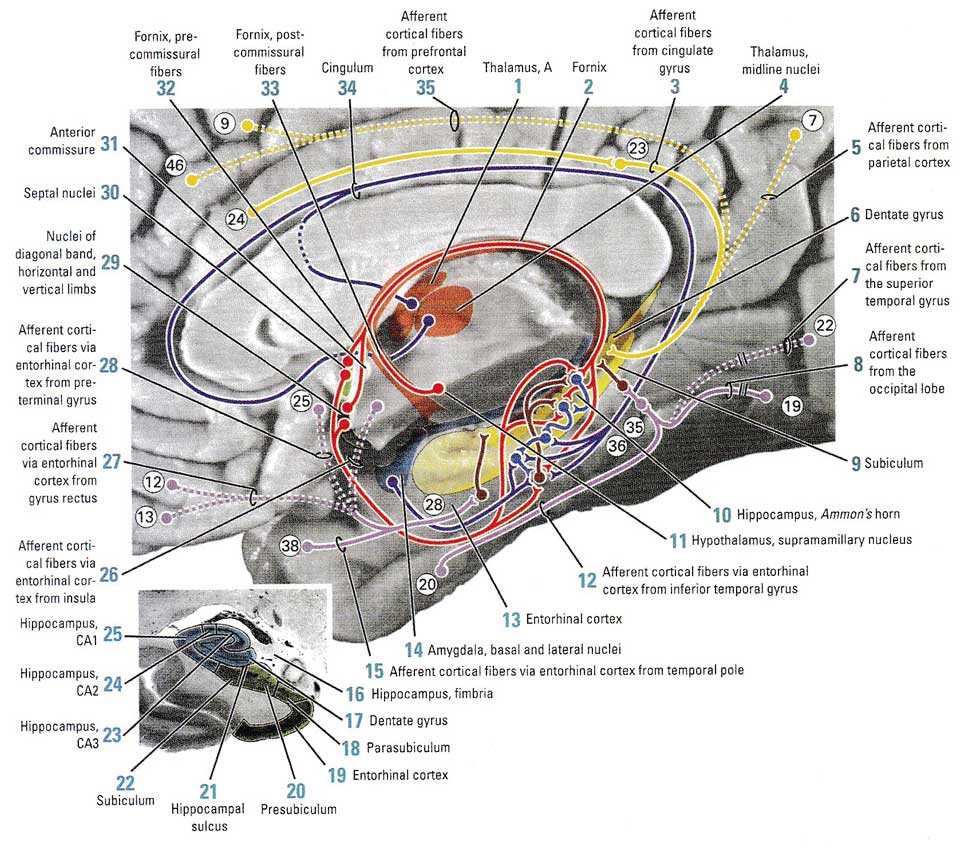
Рис. 1 Афферентные проекции гиппокампа. Репродукция из Woolsey T et al. The Brain Atlas: A visual guide to the human central nervous system, 2n-е издание. 2002, стр. 213
Большинство эфферентных гиппокампальных путей начинается в Аммоновом роге и субикулуме (его основании).
Волокна основания гиппокампа формируют свод мозга, который разделен передней комиссурой на прекоммиссуриальный и посткомиссуриальный свод. Аксоны прекомиссуриального свода имеют синаптические связи с ядром перегородки, прилежащим ядром (nucleus accumbens), преоптическим ядром, а затем дают проекции в медиальную фронтальную кору и прямую извилину (gyrus rectus), включая поля 11, 12, 13, 25 и 32 соответственно. Посткомиссуриальный свод проецируется на интерстициальное ядро терминальной полоски (stria terminalis), передние ядра таламуса, вентромедиальные и латеральные мамиллярные ядра гипоталамуса. Дополнительные волокна из основания гиппокампа связываются прямо с базальными и латеральными ядрами миндалины, энторинальной корой, ретроспленальной корой. Часть из этих волокон проходят поясной тракт и заканчиваются в поясной извилине. Волокна из Аммонова рога приходят в ядра перегородки через прекомиссуриальный свод (рис. 2) 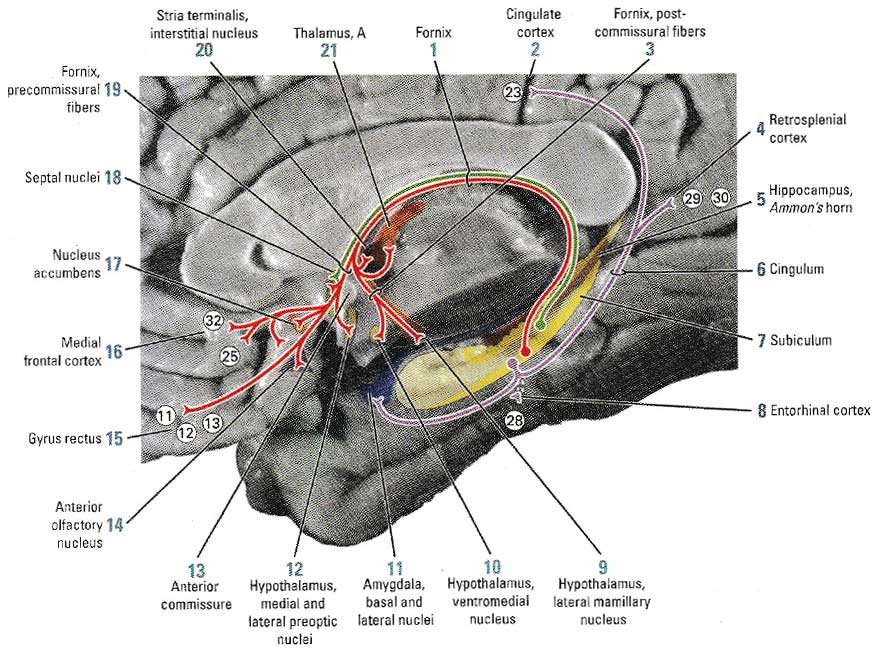
Рис. 2 Эфферентные проекции гиппокампа. Репродукция из Woolsey T et al. The Brain Atlas: A visual guide to the human central nervous system, 2n-е издание. 2002, стр. 213
Амигдала (миндалина)
Миндалина получает информацию от сенсорных систем через висцеральные афференты. Структура состоит из из пяти небольших ядер организованных в три группы: центральное ядро, кортикальное и медиальные ядра, базальные и латеральные ядра.
Афферентные (восходящие) пути миндалины
У миндалины пять главных афферентных путей. Проекции из передней и височных долей мозга дают терминали в следующих ядрах: островковые волокна и волокна из полей 20, 21, 22 и 38 проецируются в центральное ядро; островковые волокна, волокна из полей 20, 21, 22, 35, 36 и 38 и некоторые афференты основания гиппокампа проецируются в базальные и латеральные ядра. Другие проекции основания идут в кортикальном и среднем ядре миндалины.
Далее, аксоны из полей 12, 13, 14, 23, 24 и 25 соединяются с центральным ядром, в то же время аксоны полей 11, 12 и 24 проецируются на базальное и латеральные ядра. Аксоны интерстициального ядра совместно с аксонами из вентромедиального ядра гипоталамуса заканчиваются в центральном, медиальном и кортикальном ядрах миндалины. Волокна из обонятельной луковицы дают терминали в медиальном и кортикальном ядрах. (рис. 3). 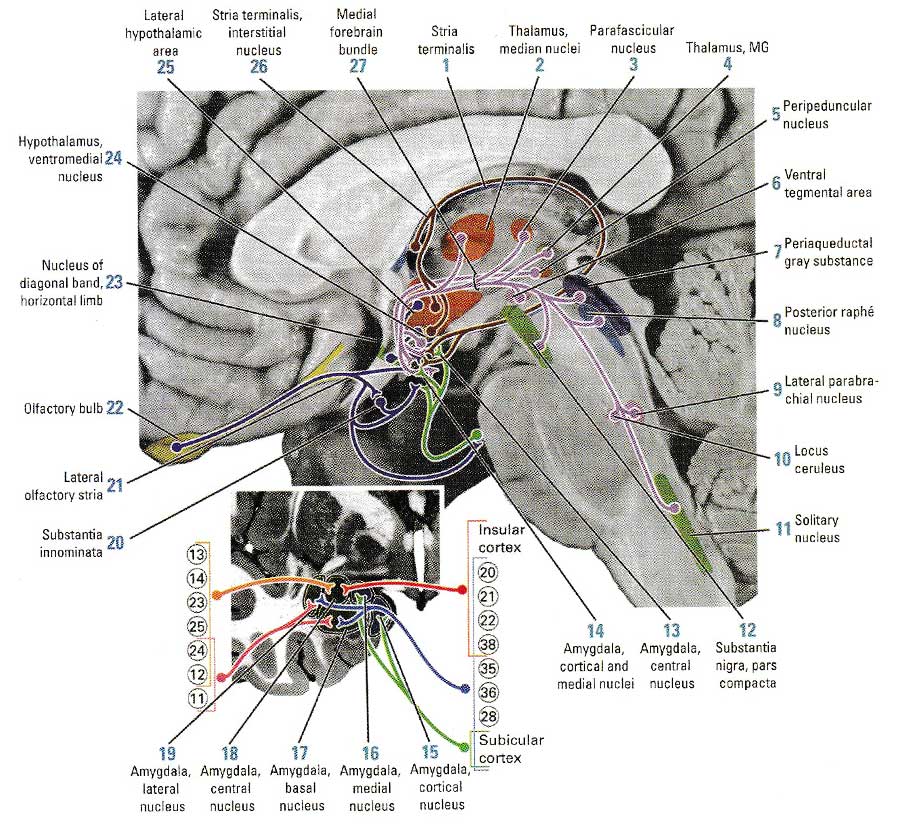
Рис. 3 Афферентные пути миндалины. Репродукция из Woolsey T et al. The Brain Atlas: A visual guide to the human central nervous system, 2-е издание. 2002, стр. 217
Эфферентные пути миндалины
Пять амигдалярных ядерных проекций используют четыре группы аксонов. Центральное ядро миндалины имеет проекции в безымянную субстанцию, ядро диагональной иззилины, латеральную гипоталамическую область, интерстициальное ядро stria terminalis (группы ядер, расположенной между хвостатым ядром и таламусом) и септальное ядро (ядро перегородки). Аксоны из центрального ядра также входят в средний пучок переднего мозга и достигают своих целей в стволе мозга. В среднем мозге волокна оканчиваются в парафасцикулярном ядре, области вентральной покрышки, компактной части черной субстанции, перпендикулярном ядре, околводопроводном сером веществе и дорсальном ядре шва. В мосте и продолговатом мозге проекции оканчиваются в передних центральных ядрах, латеральном парабрахиальном ядре, голубом пятне, nucleus subcoeruleus, большом ядре шва, бледном шаре, солитарном тракте и дорсальных ядрах блуждающего нерва.
Амигдалярные эфференты из базального, латерального, медиального и кортикального ядер проходят через stria terminalis и иннервируют интерстициальное ядро, а также паравентрикулярное, переднее, вентромедиальное и преоптическое ядра гипоталамуса. Волокна из базального и латерального ядра, которые связаны со stria terminalis, также иннервируют хвостатое ядро и скорлупу, NAc и ольфакторный бугорок теленцефалона. В дальнейшем некоторые нейроны связываются напрямую через височную долю с ядром перегородки и ядрами диагональной извилины.
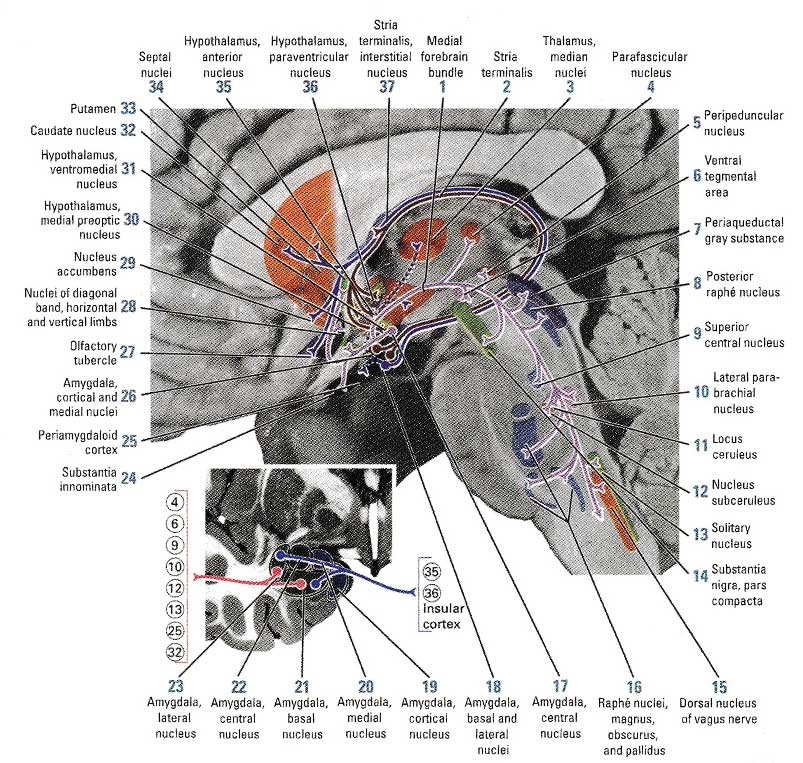
Рис. 4 Эфферентные пути миндалины. Репродукция из Woolsey T et al. The Brain Atlas: A visual guide to the human central nervous system, 2-е издание. 2002, стр. 219
Префронтальная кора
Нейроанатомические, гистологические и фармакологические исследования подтверждают гипотезу о том, что кортикальные афференты, начинающиеся в гиппокампе и миндалине, сперва проецируются на специфические структуры орбитальной и медиальной префронтальной коры. Это отмечается как у обезъян, так и у людей 6. Исследования с контрастированием позволили отследить более чем 20 архитектонических полей, дифференцированных в орбитальной и медиальной коре.
Согласно ряду исследовательских концепций, эти области можно условно сгруппировать в две большие интерактивные«сети». Орбитальная сеть получает сенсорные входящие сигналы, включая запах, вкус, висцеральные и соматические афференты, импульсы от зрительных анализаторов. Медиальная сеть, по контрасту, обеспечивает главные эфференты для висцеромоторных структур в гипоталамусе и околоводопроводном сером веществе. Эти две сети имеют выраженные связи с лимбическими структурами, стриатумом и медиадорсальным таламусом. Также представляется вероятным что множественные взаимосвязи между двумя сетями поддерживают информационный обмен между висцеросенсорной и висцеромоторной системами.
Нейротрансмиттеры в биологии депрессии
По результатам множества исследований можно утверждать, что нейротрансмиттеры играют огромную роль в нейробиологии расстройств настроения. Тем не менее, до сих мор неясно, представляют ли они первичный модулирующий сигнальный путь или конечный. Основные нейротрансмиттеры, задействованные в этом регуляторном пути — это серотонин, норадреналин (нореэпинефрин, амер.), дофамин и гамма-аминомасляная кислота (ГАМК, GABA).
Роль серотонина в нейробиологии депрессии
В мозге серотонина образуется немного, порядка 5% от количества, вырабатываемого энтерохромафинными клетками эпителия желудочно-кишечного тракта. Серотонин мозга синтезируется в большей части дорсального ядра шва (raphe nucleus). Секреция регулируется 5-HT1A ауторецепторами, расположенными в клетках. Ядро шва локализовано вдоль средней линии ствола мозга, а дорсальная (верхняя) его часть с эфферентными проекциями, ориентирована рострально (спереди). Каудальная (задняя) группа, которая включает большое ядро шва (raphe magnus), темное ядро шва (raphe obscurus, бледное ядро шва (raphe pallidus) и кластер нейронов в латеральной ретикулярной формации, дающий проекции, главным образом в задний ствол мозга.
5-HT-рецепторы обладают наибольшим разнообразием среди аминных рецепторов. Их проекции достигают отдаленных участков мозга. Серотонинергическая система может регулировать другие нейротрансмиттерные системы за счет большого количества взаимосвязей. Главная роль центральной 5-HT-структуры — регулировать ингибирующую поведенческую систему, также она задействованы в регулировании приема пищи, циркадных ритмах, настроении, тревожности, сне, агрессии и импульсивности. Дисфункция серотониновой системы предположительно сопровождает большое количество психиатрических заболеваний. 9.
5HT-рецептор а основе структурного сходства подразделяются на семь семейств. Каждый рецептор имеет специфическую локализацию и отчетливый эффекторый путь. 5HT- рецепторы 1,2,4-7 являются членами суперсемейства G-протеиновых рецепторов. 5HT3 отличаются и принадлежат к семейству лиганд-зависимых ионных каналов. Самое большое семейство 5HT рецепторов — 5HT1 с пятью подтипами. Рецепторы HT51A действуют как соматодендритные авторецепторы в ядре шва и постсинаптически в гипоталамусе, септуме и миндалине, где инициируется торможение нервных импульсов. Также данные рецепторы локализованы в астроцитах фронтальной коры и лимбической системы. Мыши, у которых отсутствуют рецепторы 5-HT1A показывают повышенную тревожность, вызванную увеличение серотонинэргического тона вследствие отсутствия негативной обратной связи в авторецепторах 5-HT1A.
За высвобождением 5-HT в синаптическую щель следует инактивация, и затем он транспортируется обратно в пресинаптическую терминаль транспортером серотонина 5-HTT. Деградация может осуществляться как моноаминооксидазой (МАО) до 5-гидроксииндолеацетиловой кислоты (5-HIAA), так и упаковкой в секреторные везикулы через 5-HTT.
Человеческий 5-HTT вольтаж-зависим и может изменять возбудимость нейронов. При депрессии часто наблюдается снижение тромбоцитарного 5-HTT. Трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина также связываются с 5-HTT. Есть основание полагать, что большинство антидепрессантов, использующихся в клинической практике, являются потенциальными антагонистами 5-HTT. Исследования на людях и животных выявили вклад серотонина в нейробиологию эпилепсии височной доли. Генетически склонные к эпилепсии крысы имеют сниженную концентрацию гиппокампальных 5-HT рецепторов и ухудшение серотониновой активности может увеличить вероятность судорожных припадков. Антисудорожный эффект, индуцированный серотонином, в основном регулируется 5-HT1A рецепторами гиппокампа. Исследования на людях выявили снижение связывания серотонина с рецепторами 5-HT1A во время приступов, распространяющихся из височной доли, шва среднего мозга и таламуса.
Снижение доступности 5-HT 1A рецепторов хорошо коррелирует с эпилептогенностью кортикальных областей. Транспортеры 5-HT — это трансмембранные протеины, ответственные за обратный захват серотонина из синаптической щели. 5-HTT кодируется одной копией гена (SLC6A4), которая имеет два общих полиморфизма: инсерция/делеция базовых пар оснований в области промотера (полиморфная область 5-HTT, связанная с геном 5-HTTLPR) и изменения во втором интроне (VNTR-2). Это демонстрирует, что длинные (L) и короткие (S) варианты 5-HTTLPR различным образом модулируют транскрипцию гена 5-HTT, где L-вариант более эффективен в рецессивном модусе. Подобным же образом, аллели VNTR-2 с 12 повторами обладают более сильными свойствами, чем короткие аллели. Генетические вариации 5-HTT могут влиять на базальный церебральный метаболизм в лимбических структурах в нормальных популяциях и ассоциироваться с депрессией, шизофренией, суицидальным поведением.
Роль норадреналина (норэпинефрина) в нейробиологии депрессии
Норадреналин — симпатический нейротрансмиттер с обширными связями во всем мозге. Тела клеток норадреналина найдены в синем пятне (LC, locus coeruleus) дорсального моста. Много структур участвуют в медиации стрессовых ответов в следующих областях: паравентрикуларные ядра, латеральный гипоталамус, преоптическая область. Все они отправляют проекции в голубое пятно, подтверждая роль норадреналиновых систем в стрессе и состоянии бодрствования. Много эфферентов из Locus Coeruleus (голубого пятна) — кортикальные терминали, оканчивающиеся в слоях I, IV и V, подтверждая роль норадреналина в модуляции интракортикальной и таламокортикальной передачи. Эти открытия позволяют судить о проекциях таламуса, играющих роль в координации уровней бодрствования сознания (arousal), а также в передаче сенсорных и моторных сигналов. Проекции в таламус важны при обучении и запоминании, а гипоталамические волокна обладают эндокринным эффектом, стимулирующим бодрствование.
Норадреналиновые рецепторы подразделяются на альфа и бета классы. Альфа рецепторы имеют два подкласса, α1 и α2, такие же отчетливые, как и α и β. Некоторые исследователи используют мышей с α2а- и α2с- адренергическими рецепторами, полагая, что αа2а-репепторы «стрессозащитные», а α2с могут наоборот вызывать стресс. Все рецепторы норадреналина принадлежат к суперсемейству G-протеинов, медиирующих медленный нейромодуляторный постсинаптический ответ. У депрессивных пациентов отмечается дисфункция норадреналиновой системы12. Есть основание утверждать что долговременный стресс снижает количество α2a-рецепторов, особенно в миндалине и гиппокампе. А в синем пятне, где сосредоточено наибольшее количество ядер, содержащих норедреналин, наблюдается увеличение количества α2 адренергических рецепторов у жертв удавшегося суицида с историей большого депрессивного расстройства. Результаты также показывают усиление активности тирозин-гидроксилазы в синем пятне в дополнение к уменьшению плотности транспортера норадреналина. Большинство данных эффектов сопровождается истощением норадреналина в мозге, в какой-то степени восполняющегося терапией антидепрессантами.
Роль дофамина в нейробиологии депрессии
Нейсротрансмиттер дофамин транспортируется в синаптические везикулы дофаминэргических и норадренергических нейронов посредством амино-специфических транспоттеров. Норадреналиновые нейроны, однако, содержат дофамин-бета гидроксилазу, которая быстро трансформирует дофамин в норадреналин за счет гидролиза бета-карбона. После того, как норадреналин высвобождается в синаптическую щель, транспоттер быстро возвращает его в терминаль синапса. Эти специфические связи расположены во внешней мембране синаптического окончания. Транспортер норадреналина ингибируется множеством классов антидепрессантов, повышающих его концентрацию в синапсах. Отмеченр, что леводопа (L-DOPA) снижает симптоматику, связанную с настроением, у больных паркинсонизмом. Ингибиторы обратного захвата дофамина, такие как бупропион, изучаются как антидепрессанты. Потенциальная роль дофамина в нейробиологии депрессии в дальнейшем получила подтверждение локализацией дофаминергических проекций из вентральной тегментальной области (покрышки среднего мозга) в префронтальную кору, стриатум и переднюю поясную извилину.
Однако нет сведений о том, что одна только дофаминергическая стимуляция способна купировать симптомы депрессии13. Роль гамма-аминомасляной кислоты в нейробиологии депрессии Достаточно давно замечено, что дефицит гамма-аминомасляной кислоты (ГАМК) в центральных нейронах может вызвать симптомы депрессии. У многих депрессивных пациентов зафиксировано снижение ГАМК в плазме крови и сниженное количество ГАМКb(бета) связывающих сайтов. Сходные изменения в мозге выявили у людей, совершивших самоубийство. Некоторые эксперименты показывают, что ГАМК оказывает значимый ингибирующий эффект на биогенные амино-нейротрансмиттеры, и в этот эффект вовлекаются локальные нейронные сети посредством интернейронов. Дефицит гамма-аминомасляной кислоты, наблюдающийся при расстройствах настроения, дополняет гипотезу изменений в функциях норадреналина и серотонина при подобных заболеваниях.
Нейробиологические модели депрессии
Моноаминергическая теория
Эффективные антидепрессанты достигают своих первичных биохимических эффектов за счет синаптической регуляции серотонина и норадреналина. Было отмечено, что резерпин, расщепляющий оба этих моноамина, может форсировать депрессивные эпизоды. Так, «моноаминергическая гипотеза» предполагает что депрессия вызывается снижением выработки соответствующих моноаминов. Два структурно независимых химических соединения, ипрониазид и имипрамин, изначально разработаны не для психиатрического применения. Тем не менее, они обладают антидепрессивным потенциалом, показывая повышение уровней серотонина и норадреналина.
Сигнальные пути от специфических нервных сетей , которые модулируют сигналы , генерированные нейротрансмиттерной и нейропептидной системой 14. cAMP-каскад — главный внутриклеточный путь, медиирующий эффект от нескольких классов антидепрессантов (5-HT и NE) 15. Активация рецептора приводит к образованию cAMP за счет стимуляции аденилат-циклазы G-протеином подтипа Gsa{alpha}. Затем активируется cAMP -зависимая протеин-киназа (PKA) и один из ее субстратов — фактор транскрипции CREB (cAMP response element-binding protein). Этот протеин в своей фосфорилированной форме регулирует транскрипционную активность. Чрезмерная выработка CREB в гиппокампе приводит к антидепрессивному эффекту и предполагается, что CREB может служить молекулярной целью для терапевтических агентов16.
Постоянно принимаемые антидепрессанты также обладают влиянием на CREB в гиппокампе. Данный эффект воспроизводится также в post-mortem тканях человека и животных. Текущие семейства антидепрессантов имеют хороший терапевтический эффект, но они разработаны все еще для повышения уровня моноаминов, как ингибированием обратного захвата (СИОЗС), так угнетением деградации (ингибиторы МАО). Депрессивное расстройство — это не просто недостаток моноаминов. Ингибиторы МАО и СИОЗС немедленно повышают трансмиссию моноаминов, однако эффекты в улучшении настроения наступают через дни и недели непрерывного лечения. Экспериментальное снижение уровня моноаминов может ухудшить настроение у депрессивных больных, не получающих лекарства, но не оказывает никакого влияния на здоровых людей.
Существенное увеличение в количестве синаптических моноаминов, индуцированное антидепрессантами, продуцирует вторичные нейропластические изменения, в которых задействованы транскрипционные и трансляционные механизмы молекулярной клеточной пластичности. На сегодняшний день моноаминергические антидепрессанты остаются первой линией лечения при депрессии. Но их длительная терапевтическая задержка в купировании симптомов и низкий уровень ремиссии вдохновляют ученых на поиск более эффективных агентов. Рецепторы серотонина, вовлеченные в SSIRs остаются по большей части, неизученными, также интересны селективные агонисты рецептора 5-HT4, дающие мгновенный эффект у грызунов. Эксперименты с P-глигопротеин-дефицитными мышами, показали, что несколько антидепрессантов являются субстратами для гликопротеинов. Весьма существенным является полиморфизм в человеческом гене, кодирующем P-гликопротеин (P-гликопротеин — молекула в гематэнцефалическоим барьере, транспортирующая специфические молекулы обратно в кровь). За счет этого эффективность фармакологических тестов и индивидуальное воздействие медикаментов может сильно варьироваться от субъекта к субъекту.
Теория дисфункции гипоталамо-гипофизарно-надпочечниковой оси (HPA)
Ось HPA важна для понимания нейробиологии депрессии. Активность оси контролируется специфическими областями мозга, включая гиппокамп (ингибирующее влияние на гипоталамические нейроны) и миндалина (амигдала, с прямым возбуждающим действием). Глюкокортикоиды не дают сильной обратной связи с осью HPA и при определенных физиологических условиях, похоже, усиливают подавление активности HPA, а, возможно, и всей функции гиппокампа в целом. Хорошо задокументировано, что нейроны из паравентрикулярного ядра таламуса выделяют кортикотропин-релизинг фактор (CRF), который стимулирует синтез и высвобождение адренокортикотропина (ACTH) в передней части гипофиза. ACTH стимулирует синтез и выброс глюкокортикоидов из коры надпочечников. Пролонгированная, возрастающая концентрация глюкокортикоидов, к примеру, во время стресса, опасна и может повредить нейроны гиппокампа, возможно за счет редукции дендритных ответвлений и потери дендритных корешков включая глутаматергические входы. Клинические исследования показывают, что избыточная активация гипоталамо-гипофизарно- надпочечниковой оси отмечается в половине депрессивных эпизодов и этот эффект частично обратим терапией антидепрессантами.
Последние исследования также отмечают гиперсекрецию кортикотропин-релизинг фактора (CRF) у некоторых депрессивных пациентов, которые также отказались от терапии антидепрессантами. CRF - важнейший нейротрофический медиатор стрессовых ответов в центральной нервной системе, он экспрессируется в паравентрикулярных ядрах гипоталамуса и его задача — координировать выброс адренокортикотропина из переднего гипофиза. Уровень CRF увеличен в спинномозговой жидкости больных депрессией и самоубийц.
В нашем мозге в изобилии втречаются два CRF- рецептора, CRF-1 и CRF-2, оба, согласно гипотезе, вовлечены в стрессовые ответы. Центральное введение CRF-1 антисенс-олигодеоксинуклеотидов может вызвать анксиолитические (противотревожные) эффекты, уменьшающие возбуждение при избытке CRF и физиологическом стрессе. Также отмечается снижение количества CRF-рецепторов во фронтальной коре депрессивных пациентов по сравнению с контрольной группой. Более того, хроническое введение CRF нормальным добровольцам показало картину в части гипоталамо-гипофизарно- надпочечниковой оси, неотличимую от той, которую дает картина большого депрессивного расстройства.
Нейротрофическая теория
Нейротрофическая теория депрессии базируется на исследованиях нейротрофических факторов и их роли в нейробиологии депрессии и ее лечении.
Предыдущие исследования описывали роль нейротрофических факторов в регуляции нейронного роста и дифференциации в процессе развития нейронов. Однако, более поздние исследования предположили важную роль этих факторов в пластичности и выживаемости взрослых нейронов и глиальной ткани. BDNF (Brain Derived Neurotrophic Factor) — один из членов группы семейства факторов роста, обладающий возможностями усиливать синаптическую передачу, стимулировать выживание и рост взрослых нейронов за счет активации трансмембранных рецепторов, содержащих собственные тирозин-киназы B (TRKB).
У животных стресс снижает уровень экспрессии BDNF в зубчатой извилине и пирамидальных клетках гиппокампа. Это редукция, похоже, контролируется действиями глюкокортикоидов и увеличением транскрипции серотонина. Долговременное, но не одиночное введение антидепрессантов, так же как и регулярное электросудорожное лечение повышает BDNF-экспрессию и предотвращает вызванное стрессом снижение уровней BDNF.
В посмертных исследованиях в ряде случаев было зафиксировано увеличением экспрессии BDNF в зубчатой извилине, холме и супрагранулярной области у пациентов, которые получали лечение, по сравнению с контрольной группой18. Индуцирование BDNF антидепрессантами как минимум частично контролируется CREB. Было отмечено, что длительное лечение антидепрессантами усиливает cAMP-каскады в гиппокампе и коре, повышают уровни cAMP-зависимых PKA, и усиленно экспрессирует CREB. Все эти исследования показывают, что биологические агенты, активирующие эти пути, могут потенциально быть использованы в лечении депрессии. cAMP-специфическая фосфодиэстераза (фосфодиэстераза, ингибитор, тип 4 PDE4) ответственна за разрушение cAPM, а ингибиторы фосфодиэстеразы отвечают за предотвращение деградации cAMP. Предположение о том, что ингибиторы фосфодиэстеразы могут теоретически снижать симптоматику депрессии, привело к появлению новой стратегии в разработке антидепрессантов.
С большой долей уверенности, основываясь на преклинических исследованиях, мы можем показать, что некоторые формы стресса снижают BDNF-регулируемую сигнализацию в гиппокампе, и это поддается восстановлению длительным лечением антидепрессантами. Такие же изменения в гиппокампе подтверждаются и исследованиямии post-mortem. Все эти явления наводят на мысль, что могут существовать сложные взаимосвязи между полиморфизмом BDNF, полиморфизмом транспортировки серотониновых генов и стрессовыми явлениями.
Маркер клеточного эффекта лечения антидепрессантами — усиление нейрогенеза во взрослом гиппокампе. Более того, лечение антидепрессантами (возможно посредством действия CREВ или других танскрипциональных регуляторов) активирует несколько факторов нейрогенеза в гиппокампе. Прежде всего, это BDGF, а также фактор васкулярно-энтоделиального роста, который у грызунов сочетает нейрогенез и антидепрессивные свойства. Механизм, при котором новые нейроны как-то меняют настроение, неясен.
Стимуляция депрессивных симптомов как ответ на стресс может различаться между разными нервными контурами. Здесь важно заметить депрессию вызванную лежащими в основе ее симптомами в отсутствии внешнего стресса. Кажется правдоподобным, что нейропластические события требуют от антидепрессантов способности действовать через сепаратные, но параллельные контуры, а также общие конечные пути.
Нейроимунная теория
Цитокины — гуморальные медиаторы, задействованные во врожденном и приобретенном иммунитете. Недавние исследования дают нам косвенные данные о том, что цитокины могут действовать также как модуляторы настроения19. Периферийные и центральные цитокины могут активировать цитокиновые рецепторы в центральной нервной системе.
Небольшие количества интерлейкина (IL)-1 продуцируют у некоторых животных снижение социального, исследовательского, сексуального поведения. Кроме того, в процессах могут участвовать альфа-интерферон, фактор некроза TNF-α, интерлейкины-6 и 1β, при этом активируется гипофизарно-надпочечниковая ось и центральная моноаминная система. Клинические исследования показывают, что приблизительно треть пациентов, получающих реконбинантный интерферон, страдают депрессией как побочным эффектом. Некоторые авторы предполагают, что это связано с другими аутоимунными заболеваниями, например, ревматоидным полиартритом, а обширный воспалительный процесс вряд ли благотворно влияет на настроение.
Некоторые доклинические стадии исследований также показывают, что блокирование про-воспалительной цитокиновой сигнализации, может спровоцировать антидепрессантный эффект. Мыши с удаленными генами интерлейкина -6 или генами, кодирующими фактор роста некроза TNF-α, показывали антидепрессивный фенотип, а центральное стимулирование антагониста рецептора интерлейкина -IL-1бета показало восстановление поведенческих реакций, нарушенных стрессом.
Регуляция синаптической пластичности за счет TNF-α и IL-1
Высокие уровни TNF-α отмечаются в нескольких невропатологических состояниях, ассоциирующихся с дефицитом внимания и расстройствами памяти. Патофизиологические уровни TNF-α ингибируют долговременную потенциацию в CA-1 области гиппокампа, а также в зубчатой извилине.
Долговременный потенциал важен для механизмов, которые могут влиять на обучение и формирование памяти. Заслуживает внимание эксперимент по выключению TNF-рецептора у мышей, страдающих долговременной депрессией. Мыши с выключенными рецепторами показывали более успешную производительность в тестах на пространственную память и легче справлялись с обучающими заданиями. Здесь примечательно, что эти опыты были сделаны in vivo. Но другие исследования роли TNF-α в регуляции синаптической пластичности, внесли определенные противоречия. Вполне правдоподобно, что существует тонкий баланс между патофизиологическим и физиологическим уровнем TNF-α .
Патофизиологическое состояние повышает центральные уровни TNF-α, а долговременный потенциал действия, похоже, угнетается. При физиологическом состоянии низкие уровни TNF-α служат модуляторами гомеостатической пластичности синапсов. Некоторые исследователи полагают, что TNF-алфа оказывает вредный эффект на пластичность синапсов, однако, физиологически низкие уровни TNF-α могут быть существенными для развития мозга и «synaptic scalling» (масштабирования синапсов). Независимо от важной роли TNF-α в гомеостатическом масштабировании, нельзя отрицать нейротоксический эффект, оказываемый TNF-алфа на ионы Ca2+, особенно когда высоки количества TNF-α во внешнеклеточном пространстве, как это наблюдается в ряде нейропатологических заболеваний. Вероятно, что IL-1 может модулировать синаптическую пластичность и воздействовать на поведенческие системы. Вероятно, патофизиологические уровни IL-1 могут негативно влиять на память, связанную с гиппокампом и соответствующие процессы обучения. В то же время возможна компенсация за счет IL-1RA, антагониста рецептора IL-1. В соответствии с этим эффектом, IL-1 может ослаблять долговременную потенциацию в гиппокампе.
Было показано в опытах на крысах, что IL-1RA влияет на память при прохождении водных лабиринтов и задач на пассивное избегание (и то и другое требует работы гиппокамп-зависимой памяти). Мыши с удаленным IL-1RA демонстрировали серьезное ухудшение гиппокампальной памяти, снижение кратковременной пластичности и отсутствие долговременной потенциации как in vivo, так и in vitro. Другие источники показывают, что физиологические уровни IL-1 необходимы для формирования памяти и небольшое увеличение уровня IL-1 в мозге может даже улучшить память. Однако, когда уровень IL-1 существенно отличался от физиологического, в случае экзогенного воздействия, эндогенного выброса или блокады сигнальных путей, результат всегда был один и тот же — снижение памяти. Интересно, что мыши с делецией рецептора IL -1 или с ограничением выброса антагониста не показывали поведения, индуцированного стрессом или нейроэндокринных изменений.
Дальнейшую поддержку гипотеза об активации иммунной системы при депрессии получила из исследования дезипрамина и флуоксетина, которые снижали воспаление в овальбумин-сенситизированных крысах в рамках липополисахаридной аутоимунной модели.
Роль цитокинов в патогенезе депрессии
Имея доказательства роли проинфламматорных цитокинов в регуляции синаптической пластичности, было бы логично помыслить о том, что активация иммунной системы может соотноситься с комплексной патофизиологией депрессивных расстройств. Гиперактивация иммунной системы сопровождается повышением уровня TH1-цитокинов. Несколько исследований на животных подтвердило, что активация IL-1, макрофагов или других иммунных клеток при липополисахаридном (LPS) лечении, провоцирует болезненное поведение. Также затрагиваются мотивация и некоторые когнитивные функции.
Мыши с недостатком энзима для синтеза IL-1 чувствуют себя лучше и после введения эндотоксинов, экспрессируют меньше генов, ответственных за выработку нейротоксичных противовоспалительных факторов в рамках иммунного ответа. Также, удаление генов TNF-aльфа рецептора 1 (TNFR) и TNF-альфа рецептора 2 (TNFR-2), производит эффект, похожий на антидепрессивный. Процент депрессивных заболеваний, ассоциированных с цитокиновой терапией, варьируется в различных статистических анализах от 0% до 40%. Такой разброс объясняется спецификой заболеваний, типом цитокина и его дозой, итоговыми показателями и психиатрической историей. В большинстве случаев, возникшие депрессивные симптомы были купированы антидепресантами.
У здоровых людей, добровольно участвовавших с исследованиях, депрессия, беспокойство, ухудшения памяти ассоциировалось с активацией иммунной системы бактериальными эндотоксинами LPS и коррелировало с уровнями сыворотки IL-1 или TNF-альфа, возросшими в процессе эксперимента. Еще ранние эксперименты над животными показали, что цитокины могут играть модуляторную роль в развитии депрессивных типов поведения. Иммунотерапия с использованием IL-2 или IFN-альфа часто ассоциируется с заметными когнитивными нарушениями и нейродегенеративными симптомами, такими как усталость, расстройство сна, раздражительность, отсутствие аппетита, подавленное настроение. Это коррелирует с повышенными уровнями IFN-альфа, IL-6, IL-8 и IL-10. Цитокины — потенциальные терапевтические модуляторы при расстройствах настроения.
Стресс — общий фактор для развития Major Depressive Disorder (MDD), большого депрессивного расстройства. Весьма правдоподобно, что ранним начальным эпизодам депрессии предшествовал какой-либо хорошо идентифицируемый стрессовый фактор. В эту гипотезу вполне укладываются те случаи, когда стресс оказывался связующим звеном между воспалительными процессами и большим депрессивным расстройством. Существуют доклинические и клинические доказательства того, что и при внезапном и при хроническом стрессе повышается уровень проинфламматорных цитокинов, таком как TNF-альфа, IL-1, IL-6, IL-12, IL-6R, IL-2, IL-2R, IL-1RA и IFN -альфа. Интересно, что и некоторые другие психиатрические заболевания , такие как биполярное расстройство или шизофрения, могут также быть ассоциированы с возрастающим воспалительным ответом и усилением количество проинфламматорных цитокинов.
Показано, что некоторые пациенты с MDD имеют дисбаланс между про- и анти- воспалительными цитокинами. Обычное лечение флуоксетином, сертралином или пароксетином приносят таким больным облегчение. Другие новые исследования указывают на то, что MDD-пациенты с ненормальными аллельными вариантами генов IL-1 и TNF-альфа и большим уровнем TNF-альфа, показывают меньшую восприимчивость к лечению антидепрессантами. Несколько исследований отметили потенциальный модуляторный ответ с последующей эксайтотоксичностью и активацией микроглии в этиологии MDD. Активация имунной системы с повышением проинфламматорных цитокинов описана у пациентов с большим депрессивным расстройством.
Существуют различные модуляторные пути, управляющие цитокинами, вносящими свой вклад в нейротоксичность глутамата: напрямую, через активацию кинурениновых путей в микроглии и увеличением продуцирования хинолиновой кислоты и выброса глутамата. А также непрямые пути — снижение активности глиальных транспортеров глутамата, что приводит в уменьшению обратного захвата глутамата из экстраклеточного пространства, и долговременной активации микроглии с выбросом TNF-альфа и IL-1. Антидепрессанты, показанные для снижения уровня вызванной альфа-интерфероном продукции IL-6 b и оксида азота (на путать с закисью) в микроглии, показывают, что ингибирование воспалительных процессов в мозге может представить новый мезанизм действия антидепрессантов.
Вызванный воспалением дисбаланс в глутаматергической нейротрансмиссии возможно просто был осложнен другими психиатрическими болезнями. Есть небезосновательное предположение, что вызванный именно глютаматовый дисбаланс может играть роль в патофизиологии психиатрических заболеваний, включая большое депрессивное расстройство, ассоциированное с существенными когнитивными нарушениями. Есть некоторые наблюдения , что антидепрессанты могут вызвать изменения в экспрессии TNF-альфа. Лечение TCA диспирамином в определенных зонах мозга истощает локализованныe в нейронах матричные РНК для выработки TNF-альфа и соответствующих протеинов, что может регулировать настроение. Деспирамин, амитриптилин, зимелидин, селективный ингибитор обратного захвата серотонина — все эти препараты снижают уровни TNF-альфа и облегчают выброс норадреналина, что важно, например, при использовании диспирамина и других норадренергических лекарств.
Амитриптилин и зимилидин трансформируют TNF-альфа регуляцию норадреналина, что приносит больным облегчение в присутствии альфа2-андренергичской рецепторной активации. Сейчас мы можем почти с уверенностью сказать, что некоторые антидепрессанты регулируют уровни TNF-альфа в головном мозге и, возможно, модулируют норадренергические, серотонинэргические и дофаминэргические нейротрансмиттеры. Так, отмечена регуляторная роль TNF-альфа индуцированной модуляции синаптической пластичности в механизме действии антидепрессанта. Антидепрессанты могут ингибировать продуцирование и выброс проинфламматорных цитокинов и стимулировать синтез анти-инфламматорных цитокинов, причем уменьшение воспаления служит в этом случае маркером эффективности лечения.
Таким образом, подавление воспалительной сигнализации может потенциально стать стратегией лечения депрессивных расстройств у пациентов перед конвенциональной терапией. Антагонисты цитокинов, похоже, обладают антидепрессивным эффектом, даже в случае отсутствия иммунной реакции. У людей, введение блокаторов TNF-альфа смягчает депрессивные симптомы, аккомпанирующие активации иммунной системы. Также возможно, что IL-4 и IL-10 могут в этой терапии оказаться весьма полезными.
Заключение
Наше понимание нейробиологии депрессии претерпело существенное развитие — от ранних спекуляций на тему избытка черной желчи к теориям химического дисбаланса. Современные гипотезы включают взаимодействие факторов, обусловленных как генетикой, так и внешней средой. Немалая роль отводится эндокринным, иммунологическим и метаболическим медиаторам. Кроме того, мы обладаем знанием о клеточной и молекулярной биологии, в частности об эпигенетических формах пластичности.
Тем не менее, существуют серьезные пробелы, мешающие нам всеобъемлюще объяснить депрессивное расстройство и методы его лечения. Новые исследования в фармакогенетике и имунно-модуляторных путях могут дать нам новые новую будущую терапию MDD. Мы лучше стали понимать биологический базис для глубокой стимуляции мозга при депрессии и терапевтические возможности вирусной доставки определенных генов, что уже успешно применяется при других нейропсихиатрических расстройствах. И, наконец, депрессия, которая проявляется как коморбидное состояние основного неврологического расстройства, может потребовать принципиально иного подхода к лечению. Депрессивное расстройство — комплексное по своей природе и требует мультидисциплинарных исследований.
Использованная литература
Hrvole Hecimovic, Загребский центр эпилепсии, департамент неврологии, университетский госпиталь. Загреб, Хорватия.
6 Price JL. Prefrontal cortical networks related to visceral function and mood. Ann N Y Acad Sci, 877:383-396, 1999
8. Duvernoy HM, The Hunam Hippocampus: Functional Anatomy , Vascularization and Serial Sections with MRI . Berlin, Germany: Springer-Verlag, 1998.
9. Delgado PL, Price LH, Miller HL, et. al. Serotonin and the neurobiology of depression. Effects of triptofan depletion in drug-free depressed patients. Arch Gen Psychiatry, 51(11):865-874, 1994
12. Wong ML, Kling MA, Munson PJ, et. al. Pronounced and sustained central hypernoradrenergic function in major depression with melancholic features: relation to hypercortisolism and corticotropin-releasing hormone. Proc Natl Acad Sci USA, 97(1):325-330, 2000.
13. Lambert G, Johansson M, Agren H et. al. Reduced brain norepinephrine and dopamine release in treatment-refractory depressive illness: evidence in support of the catecholamine hypothesis of mood disorders. Arch Gen Psychiatry, 57(8): 787-793, 2000.
14. Nestler Ej, Barrot M, DiLeone RJ, et. al. Neurobiology of depression. Neuron, 34(1): 13-25 2002.
15. Coyle JT, Duman RS. Finding the intracellular signaling pathways affected by mood disorder treatments. Neuron, 38(2): 157-160, 2003.
16 Chen AC, Shirayama Y, Shin KH, et. al. Expression of the cAMP response element binding protein (CREB) in hippocampus produces an antidepressant effect. Biol Psychiatry, 49(9): 753-762, 2001.
17 Shirayama Y, Chen AC, Nakagawa S, et. al. Brain-dericed neurotrophic factor produces antidepressant effects in behavioral models of depression. J Neurosci, 22(8): 3251-3261, 2002.
18 Chen B, Dowlatshahi D, MacQueen GM, et. al. Increased hippocampal BDNF immunoreactivity in subjects treated with antidepressant medication. Biol Psychiatry, 50(4): 260-265, 2001.
19 Khairova RA, Hado-Vieira R, Du J, et. al, A potential role for pro-inflammatory cytokines in regulating synaptic plasticity in major depressive disorder. Int J Neuropsychopharmacol, 12(4): 561-578, 2009.
Ссылки по теме
Печать книг Книжные переплеты Как сверстать книгу Технические рекомендации к макетам Типографский шрифт Спекуляции о происхождении языка История книгопечатания История энциклопедий Английские первопечатники
Немного науки
Коротко о физиологии речи Зоны речи и афазии Транскортикальные афазии Подкорковые афазии Нарушения чтения и письма Жаргон как патология Язык, рисование и правое полушарие Об эмоциях Bottom-up и top-down процессы
